こんにちは。たけぴです。
BCG接種がCOVID-19の重症化抑制に寄与するのか、世界中でヒトでの臨床研究が始まっています。以前のブログでは古典的な獲得免疫を主にBCG接種がCOVID-19抑制に働く仮説を出しました。今回は自然免疫のブースト(記憶)という側面から比較的新しい文献をもとに免疫メカニズムを考えて見たいと思います。
ちなみにこの記事は一般の医療機関でBCGを従来の結核予防以外の目的で新型コロナの予防として試みることを推奨するものではありません。
エピジェネティックとは
「ジェネティクス」という言葉は遺伝学と訳されるのですが、これに「エピ」というのが付くと「〜の後に」という意味になります。すなわちエピジェネティックを無理やり日本語にすると「後成的遺伝上の」となります。エピジェネティックという言葉は昔からありますが、研究分野での考えとしては2000年頃から一般に活発になったものです。
我々ヒトを含む脊椎動物や微生物は細胞を持っていて、その細胞の中に核を持ちその中にDNA(デオキシリボ核酸)が格納されています。そして高分子としてのDNAの中に遺伝情報が入っています。DNA分子は通常ヒストンと呼ばれるタンパク質に巻き付き繊維状の構造体で核内に分布しています。
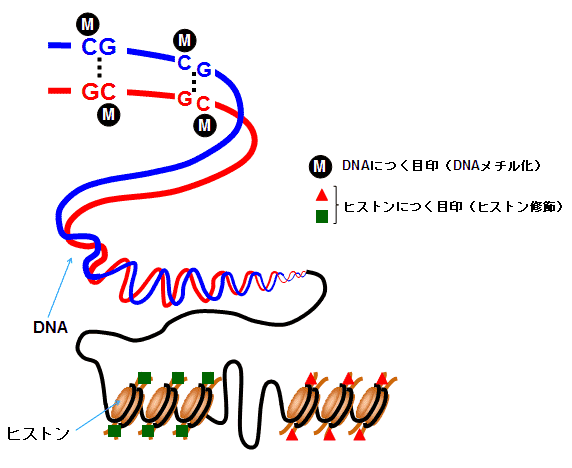
このDNAは生物が生まれ持っているものでその遺伝情報は何もなければ変化しない情報です。ただ、DNAのある部位がメチル化することで目印(標識)が付いたり、その周辺タンパク質にある科学的変化(化学的装飾)が起こると、その遺伝子に応じた分子やタンパク質が後天的に生成されます。これをエピジェネティックな変化、及び遺伝子発現といいます。化学的な装飾を受けたゲノムは「エピゲノム」と呼ばれます。この遺伝子発現はヒストンのアセチル化、脱アセチル化によって発現が亢進(アップレギュレーション)したり抑制(ダウンレギュレーション)されたりします。そしてエピジェネティックなリプログラミングとはこのDNAの目印(標識)が消去、再構成されることを意味します。エピジェネティックなリプログラミングはDNAのメチル化だけでなくRNAの発現(マイクロRNAやロングノンコーディングRNA)の調整にも関わっていると言われています。
動的な自然免疫の記憶
古典的な免疫学の解釈では免疫を「自然免疫」「獲得免疫」と分け、大まかには以下のような機能分担で考えられていました。
- 「自然免疫」はマクロファージ(以下Mφ)、樹状細胞(以下DC)、マスト細胞、ナチュラルキラー細胞(NK細胞)が病原体を非特異的に貪食、場合により病原体の特徴である抗原提示を行う。
- 「獲得免疫」はT細胞、B細胞が自然免疫系からのシグナルを受け取り侵入病原体の特徴を認識して、キラー細胞の活性化や抗体を量産して撃退を行う。一部の細胞が病原体の特徴を記憶して残り、次の臨戦体制に備える(これがワクチンの効果)。
以上の役割で考えると病原体の特徴を記憶するのは獲得免疫であると解釈されるのですが、最近の研究によると記憶は獲得免疫だけでなく自然免疫にも存在するということがわかりつつあります。古典的な解釈では自然免疫は比較的静的な反応と考えられるのですが、実際は病原体の特徴を覚えたり、病原体に対して非特異的に自然免疫力をブーストするといった動的かつインタラクティブな反応が起こっていると考えられるようになってきています。そしてそのような反応を起こすメカニズムにエピジェネティックなリプログラミングが関与していると言われています。
BCGの接種は結核菌に対する免疫を獲得するだけでなく、細菌以外にも対応する動的な自然免疫システムを強化していると考えられてきてきます。
これを説明するために少し前提知識を整理しておきます。免疫で登場するMφ, DC, T細胞, B細胞といった役者(成熟細胞)は血液の白血球や生体組織に含まれていますが、元々独立して存在していたわけではありません。それらの細胞は前駆細胞とよばれる親の細胞から分化したものです。
例えばMφで前駆細胞を分類し先祖にたどっていくと以下のようになります。
造血幹細胞(HSC)←多能性前駆細胞(MPP)←顆粒球マクロファージ前駆細胞(GMP)←顆粒球マクロファージ形成細胞(CFU-GM)←マクロファージコロニー形成細胞(CFU-M)←単球←Mφ
(詳しく知りたい方はこちらのサイトや文献を調べてみてください)
それぞれの分化で産生されるサイトカインも様々で複雑なんですね。細かいことは置いといて要は造血幹細胞(HSC)や多能性前駆細胞(MPP)が骨髄の中にありMφの場合これが成熟細胞の大元の細胞である、ということです。
さてBCGに話を戻します。こちらの論文によると、BCG(BCG Tice株)を投与するとHSC,MPPを刺激(再プログラム)しエピジェニックに再修飾されたMφが生成される、ということがマウスモデルで確認されています(※1)。
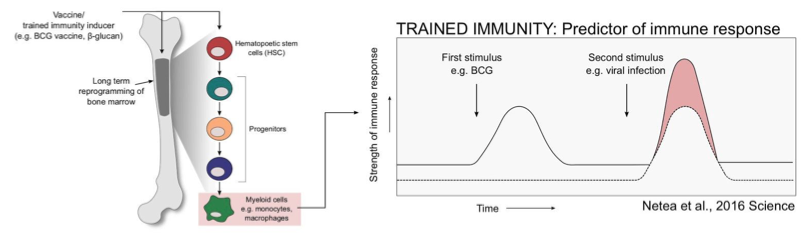
ちなみにワクチン接種によってHSCから作られる白血球細胞及びその分化細胞の増殖にはいくつかのパターン認識受容体(PRR)、IFNγ等のサイトカイン、G-CSFなどの刺激因子が関与しています。
HSCは自己複製細胞なのでBCG等のワクチンがHSCに間接的に何らかの形で分化細胞を特徴づけるマーク(エピゲノミックな標識)を残しているとすると、BCGが一般病原体に対しての自然免疫記憶を持たせる可能性があることもうなずけます。この論文では実際にBCGを接種したマウスではそうでないマウスでの場合と比較してHSC, MPPともにアップレギュレートした遺伝子が発現されていた結果を示しています。(一方で興味深いことにリンパ球への分化に関係する遺伝子はダウンレギュレートされていたとのこと。)HSCから分化したMφが結核菌の意図的な感染に対してBCGを接種したマウス(念の為骨髄にあるT細胞を枯渇させたマウスを使用)の方が保護的であることを示しています。そしてそのようなMφは炎症性サイトカインであるIFNγ, Tnf, IL-1βを産生する遺伝子発現レベルが高く、発現遺伝子はH3K4me3, H3K27acであることが示されています。→(※A)
また別の文献ではBCGとは関係なくこれらH3K4me3, H3K27acは樹状細胞(DC)が(単球から)産生される時にも関与していることが分かっています。(※2)
このことから自然免疫が発動してから、これらの発現遺伝子をキーにしてMφが活性化する時期を同じにDCが活性化し抗原提示により速やかに獲得免疫に移行する可能性が考えられます。→(※B)
ちなみにH3K4me3, H3K27acがゲノム的にどのような特徴、細胞分化のメカニズムなのか興味が湧くところです。H3K4me3はヒストンのメチル化、H3K27acはヒストンのアセチル化を表します。これは細胞の分化を迅速に活性化/抑制される準備が出来ている状態を表すらしいです。(※3)
詳しくは私の理解を超え説明できませんのでここではこれ以上深入りしません。(詳しい人いたら教えてください)
以上はBCGがMφ等の自然免疫細胞を強化する全ての説明ではありませんが、古典的な解釈では導けない1つの機序を説明していると思われます。
BCG接種が免疫反応に与える影響
BCG接種によるMφ内の機序
BCGは結核菌を弱毒化したものですので、BCGが体内に入った免疫反応は結核菌が感染した時の内部機序と似ているはずです。結核菌は100年以上も前から知られているにも関わらずその驚くほど複雑な体内での機序は最近知られてきたばかりです。その詳細はこちらの文献を参照いただければと思いますが(※4)、ここではその一部を紹介します。
一般的な細菌は体内に入るとMφなどの貪食細胞に食べられます。Mφはいわば胃袋のように消化する器官(ファゴゾーム)を持っていてこの胃袋に病原菌が巻き込まれると分解されてしまいます。ところが結核菌はMφに食べられた後にあの手この手を使って消化されてしまうのを防いで、Mφの中で一定期間増殖する能力を持っているのです。
ファゴソームに入った病原体は通常はリソソームに含まれる酵素によって分解されて、Mφ内ではファゴリソソームが形成されます。ところが結核菌の場合はLAMと呼ばれる菌壁成分や結核菌が産生するメタロプロテアーゼ(Zmp1)がMφの中のカスパーゼ1の活性化を阻害することで、このファゴリソソーム融合を阻害することが出来ます。カスパーゼ1はIL-1βの前駆体pro-IL-1βをプロセッシングし、IL-1βを分泌できる状態にする効果があります。(※5)
このようにして結核菌はMφの中で生き延びることができ、その後感染されたMφは様々な機序によりTNF-α, IL-1, IL-12, IL-18などのサイトカインを産生しMφを活性化します。
【2020/05/27追加】
上記のファゴゾームへの取り込みはオートファジー誘導と呼ばれるメカニズムによって起きています(※7)。オートファゴゾームの形成とオートリソソームの形成の後に結核菌は分解されますが、分解後に抗原提示されるかは分かっていません。Mφ又はDCにより結核菌分解後に抗原提示が起きるとすればその抗原と、同様の機序でCOVID-19が分解された後の抗原に共通性がある可能性があります。もしこれが正しければBCGがCOVID-19に効果がある決定的な証拠になるでしょう。
T細胞に関連する感染防御応答に与える影響
【2020/05/15 追加】
マウスを使った実験ではBCGをマウスに与えた時、IFNγ, TFNαのサイトカインやケモカインを産生し、Mφや好中球などの炎症性細胞が活性化することが分かっており、PD-1に特異的に結合する物質であるPD-1Lを発現することが分かっています。PD-1とは1992年、京都大学の本庶研究室で発見された活性化T細胞に発現する受容体及びその遺伝子です。この論文ではPD-1LがPD-1受容体と結合するとにより、抑制性シグナルがTh1型T細胞の機能を阻害し、過剰な炎症反応を抑えることが示されています。PD-1はがんの免疫療法で有名な物質ですがその他の肺炎に関しての論文はあまり見かけません。BCG接種有無が長期経過後にPD-1関連シグナルの発現にどの程度影響するのか、人で確かめてみると何か知見が得られるかもしれません。
自然免疫におけるIL-1β
IL-1βは自然免疫を説明する論文でしばしば見られるサイトカインです。BCGの文脈ではこちらの論文でもIL-1βは訓練免疫において重要な役割を果たすと説明されています。実際に試験管内の単球をIL-1βで予備刺激を与えるとH3K4me3, H3K27acの遺伝子を発現して、その後外部からのウイルス感染を保護する現象を確認しました。(※6)
ここでもIL-1βとH3K4me3, H3K27acとの間に強い関係性が伺われます。
亜株による自然免疫強化の違い
ここでもう一度、以前のブログで述べた論文の実験結果を確認してみます。論文によるとBCG Tokyo株を接種したときに産生されるサイトカインはIL-1α, IL-1β, IL-6, IL-24でした。
BCG Tokyo株がもし最も自然免疫を強化しているとしたとき、最も考えられるシナリオはIL-1βが鍵になるのではないでしょうか。すなわちBCG Tokyo株接種後はMφへ感染した機序に伴いIL-1βが多く産生され、遺伝子発現が起こり、結果自然免疫を特に強化。ヒトがウイルスに感染した時は(※A)の機序によりMφが活性化し、ウイルスを貪食し撃退する。この場合は抗体はあまり作られない。もし撃退に時間がかかってもさらに(※B)の機序により速やかにT細胞を中心とした獲得免疫が発動するので抗体を産生してウイルスを撃退するので重症化には至らない、といったシナリオです。BCG Tokyo以外の株ではIL-1βはそれほど強く活性化しないがIFNγは産生するので、普通に獲得免疫が対応し中程度の症状で治まるのかもしれません。BCGを接種した場合はMφにあるNOD2という受容体を介してMφに侵入(感染)しますが、亜株による毒性の違いによりIL-1βの分泌量が異なっているのかもしれません。
当然自然免疫の(※A)の機序は結核菌以外の感染については何も述べていないのでCOVID-19に当てはまるかは分かりません。これは同様の検証をSARS-CoV-2とマウスを使った実験で確かめることが出来るでしょう。またBCG Tokyo以外の亜株でもIL-1βを長時間発現させる効果を併せることが出来れば同等のウイルス保護能力を発揮することが出来るかもしれません。(どなたかによる検証を希望します)
以上、最近の免疫学の観点からBCG接種によるCOVID-19からの保護について考えてみました。自然免疫の記憶についてはエビデンスが多くなく、特にHSCから成熟細胞までの分化の途中で遺伝子発現がどのように起きているかとその長期的維持といったメカニズムの調査がまだまだ必要だと感じます。こう考えてみると現在は古典的な獲得免疫のみの解釈から自然免疫強化という観点を付加して考えるパラダイムシフトが必要とされている時代なのかもしれません。
(※3) The Epigenetic Basis of Hematopoietic Stem Cell Aging
(※4) 結核菌による宿主感染防御の発現制御
(※5) J. F. Foley, A Calming Touch. Sci. Signal. 2, ec233 (2009).
(※7) 結核菌はマクロファージによる殺菌分解機構から どのように回避しているのか?
【参考書籍】

- 作者:武村 政春
- 発売日: 2020/04/23
- メディア: 単行本(ソフトカバー)